Bronchiolitis
Pneumologie
Inhaltsverzeichnis
- Steckbrief
- Definition
- Epidemiologie
- Ätiologie und Pathogenese
- Klassifikation und Risikostratifizierung
- Primäre und sekundäre Bronchiolitis
- Histologische Klassifikation
- Radiologische Klassifikation
- Klassifikation nach dem Krankheitsbeginn und -verlauf
- Spezielle Formen der Bronchiolitis
- Symptomatik
- Diagnostik
- Anamnese
- Körperliche Untersuchung
- Labor
- Bildgebende Diagnostik
- Direkte Zeichen
- Indirekte Zeichen
- Instrumentelle Diagnostik
- Histologie, Zytologie und klinische Pathologie
- Differenzialdiagnosen
- Therapie
- Verlauf und Prognose
- Synonyme
- Keywords
- Literatur zur weiteren Vertiefung
- Herausgeber*innen, Autor*innen
Steckbrief
Unter „Bronchiolitis“ versteht man eine heterogene Gruppe von Erkrankungen der kleinen Atemwege unterschiedlichster Ätiologie, Histopathologie, Klinik und Prognose. Primäre Bronchiolitiden manifestieren sich isoliert an den Bronchiolen und treten beispielsweise im Rahmen von Lungeninfektionen, nach inhalativen Noxen oder kryptogen (idiopathisch) auf. Die häufigeren sekundären Formen manifestieren sich im Rahmen bestimmter Grunderkrankungen, z. B. bei Kollagenosen, zystischer Fibrose oder der Bronchiektasie. Die Diagnose beruht auf der integrierten Bewertung von Anamnese, Klinik (Husten, Dyspnoe), körperlicher Untersuchung (Hinweis auf Infektion, Obstruktion, Überblähung), Lungenfunktion und v. a. dem HRCT mit den charakteristischen Veränderungen (Tree-in-Bud-Zeichen, zentrilobuläre Noduli und Mosaikmuster). Die Therapie sekundärer Formen orientiert sich an der Grunderkrankung. Die Behandlung der primären Bronchiolitiden hängt von der jeweiligen Genese ab. Bei idiopathischen Formen kommt eine Kombination aus Kortison und Makroliden in Betracht.
Definition
- Die Bronchiolitis ist eine entzündliche, potenziell vernarbende und obliterierende Erkrankung der kleinen, luftführenden Atemwege sowie der angrenzenden Gewebe mit unterschiedlicher Ätiologie, verschiedenartigen histopathologischen Veränderungen und variablem klinischem Verlauf.
Epidemiologie
Häufigkeit- Inzidenz und Prävalenz: unbekannt, selten
- alle Altersgruppen können betroffen sein
- ausgeglichen
- genetische Suszeptibilität bei der diffusen Panbronchiolitis
Ätiologie und Pathogenese
- Die Ursachen der Bronchiolitis sind sehr unterschiedlich, möglich sind z.B. toxische Gase, Chemikalien, Mineralstäube, organische Stäube oder Noxen, Tabakrauch, Infektionen, Medikamente oder Kollagenosen. Es gibt auch Formen ohne erkennbare Ätiologie (idiopathisch) (Tab. 72.1)
| Auslöser/assoziierte Erkrankung | Form der Bronchiolitis |
|
Inhalationsbronchiolitis |
| organische Stäube | Bronchiolitis bei exogen allergischer Alveolitis |
|
infektiöse und postinfektiöse Bronchiolitis |
|
sekundäre BOOP |
|
kollagenoseassoziierte Bronchiolitis |
| Colitis ulcerosa, Morbus Crohn | mit einer entzündlichen Darmerkrankung assoziierte Bronchiolitis |
|
Bronchiolitis-obliterans-Syndrom (Posttransplantationsbronchiolitis) |
| Pemphigus | paraneoplastische mit Pemphigus assoziierte Bronchiolitis |
| neuroendokrine Zellhyperplasie/DIPNECH* | neuroendokrine Zellhyperplasie mit bronchiolärer Fibrose |
| hereditäre/ethnische Faktoren | diffuse Panbronchiolitis |
| idiopathisch | Kryptogene konstriktive (obliterative) Bronchiolitis, idiopathische BOOP |
|
mit der jeweiligen Erkrankung assoziierte Bronchiolitis |
| *DIPNECH: diffuse idiopathische pulmonale neuroendokrine Zellhyperplasie; BOOP: Bronchiolitis obliterans organisierende Pneumonie | |
Klassifikation und Risikostratifizierung
- Um ein umfassendes Verständnis für die Erkrankungen der kleinen Atemwege zu erlangen, muss die Bronchiolitis von mehreren Seiten betrachtet werden.
- Klinisch-ätiologische Klassifikation: Sie berücksichtigt die Ursachen bzw. die klinischen Bedingungen, unter denen sich eine Bronchiolitis entwickelt und basiert auf der nachgewiesenen bzw. vermuteten Ätiologie oder einer bestehenden Grunderkrankung (Tab. 72.1). Die vielfältigen Überschneidungen zwischen den verschiedenen Erkrankungen und histologischen Subtypen ist in Abb. 72.1 dargestellt.
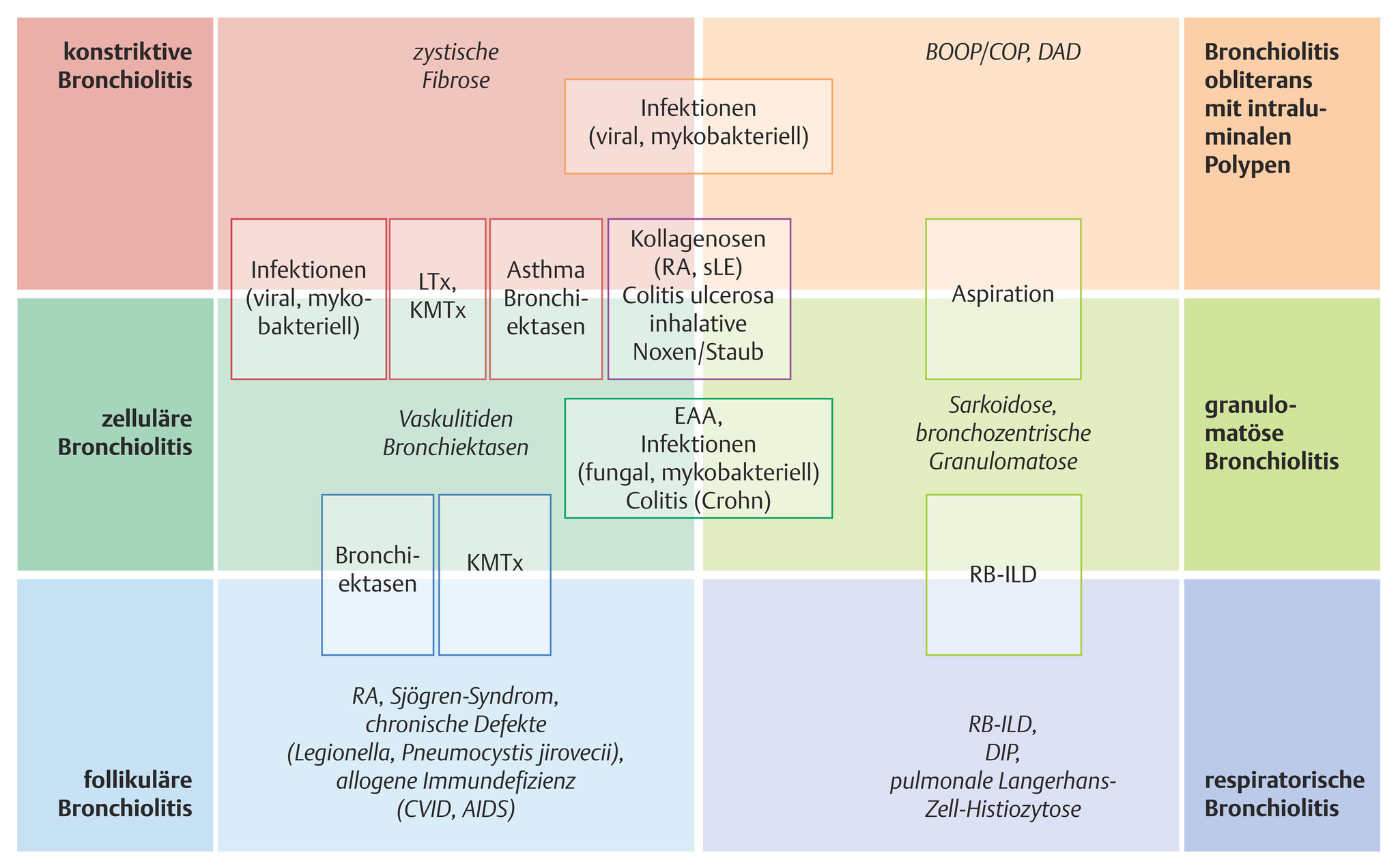
Abb. 72.1 Histologische Subtypen der Bronchiolitiden sowie der jeweils assoziierten Erkrankungen (Schema).
Die in den Kästen stehenden Krankheiten kommen mit den jeweils benannten unterschiedlichen histologischen Subtypen vor. BOOP: Bronchiolitis obliterans organisierende Pneumonie; COP: kryptogene organisierende Pneumonie; CVID: Common variable Immunodeficiency; DAD: diffuse Alveolarschädigung; DIP: desquamative interstitielle Pneumonie; EAA: exogen allergische Alveolitis; KMTx: Knochenmarktransplantation; LTx: Lungentransplantation; RA: rheumatoide Arthritis; RB-ILD: respiratorische Bronchiolitis mit interstitieller Lungenerkrankung; SLE: systemischer Lupus erythematodes
(Quelle: nach Daten aus Kroegel C, Haidl P, Kohlhäufl M, Voshaar T. Bronchiolitis. Teil 1 – Anatomische Grundlagen, Klassifikation, klinische Präsentation und Bildgebung. Pneumologie. 2012;66:28 – 38.)
Primäre und sekundäre Bronchiolitis
- Je nach Assoziation mit anderen Erkrankungen können primäre und sekundäre Bronchiolitiden differenziert werden (Abb. 72.2).
- Primäre Bronchiolitiden spielen sich isoliert an den Bronchioli ab und kommen beispielsweise im Rahmen von Lungeninfektionen vor (Abb. 72.3).
- Sekundäre Bronchioliten manifestieren sich in Verbindung mit anderen pulmonalen oder extrapulmonalen Krankheiten (Abb. 72.4).
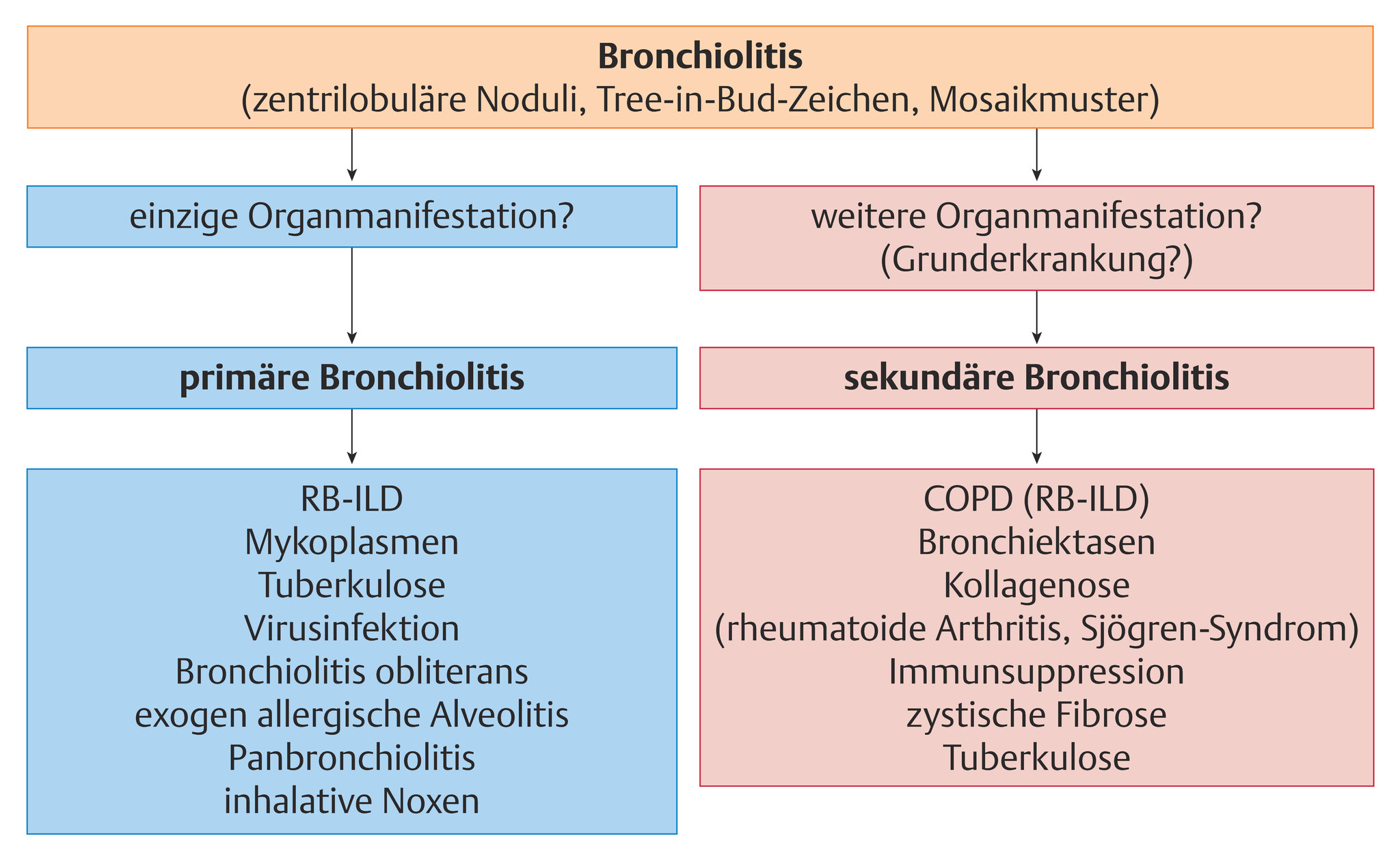
Abb. 72.2 Primäre und sekundäre Bronchiolitiden.
RB-ILD: respiratorische Bronchiolitis mit interstitieller Lungenerkrankung
(Quelle: Kroegel C. Bronchiolitis. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
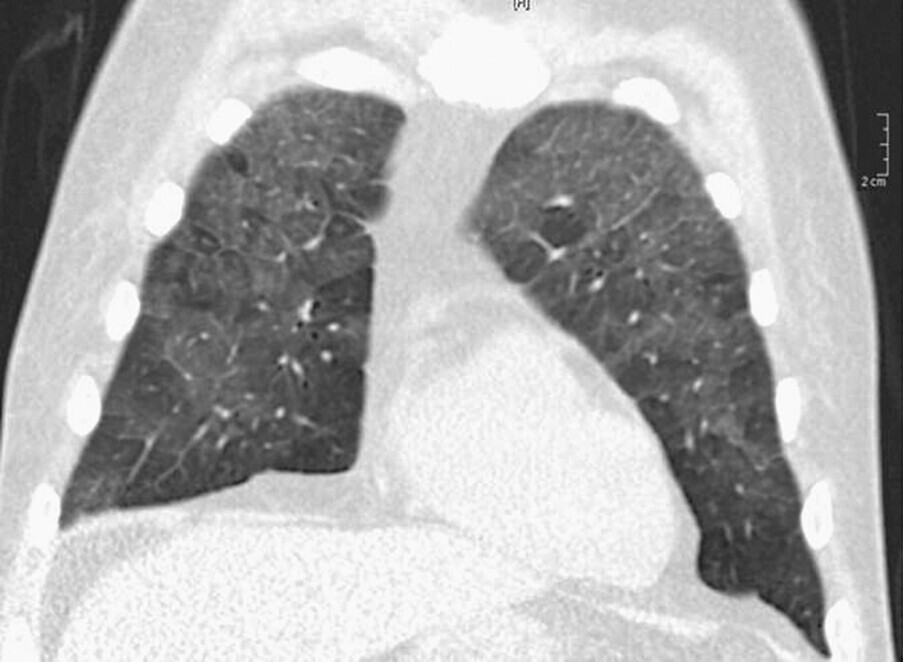
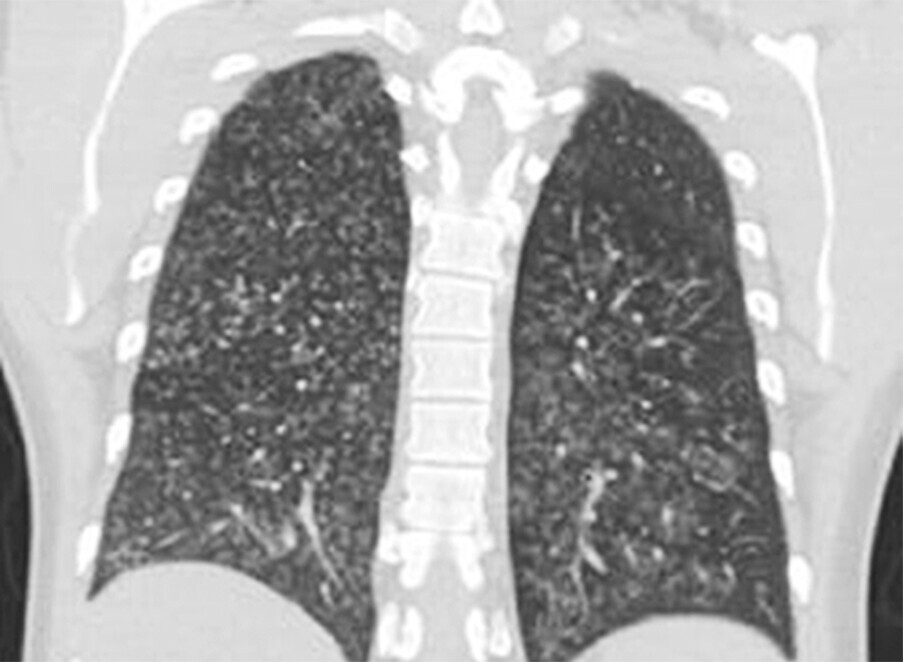
Abb. 72.3 Primäre Bronchiolitis.
a Beginnende Pneumocystis-jirovecii-Pneumonie mit apikal betontem Mosaikmuster bei einem 69-jährigen Patienten bei Immunsuppression (B-CLL). Kleine Pneumozelen sind im Oberlappen zu erkennen.
(Quelle: Kroegel C. Bronchiolitis. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. doi:10.1055/b-002-57146)
b Akute Mykoplasmen-Bronchiolitis eines 31-jährigen Patienten mit diffus verteilten, zentrilobulären Noduli.
(Quelle: Kroegel C. Bronchiolitis. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. doi:10.1055/b-002-57146)
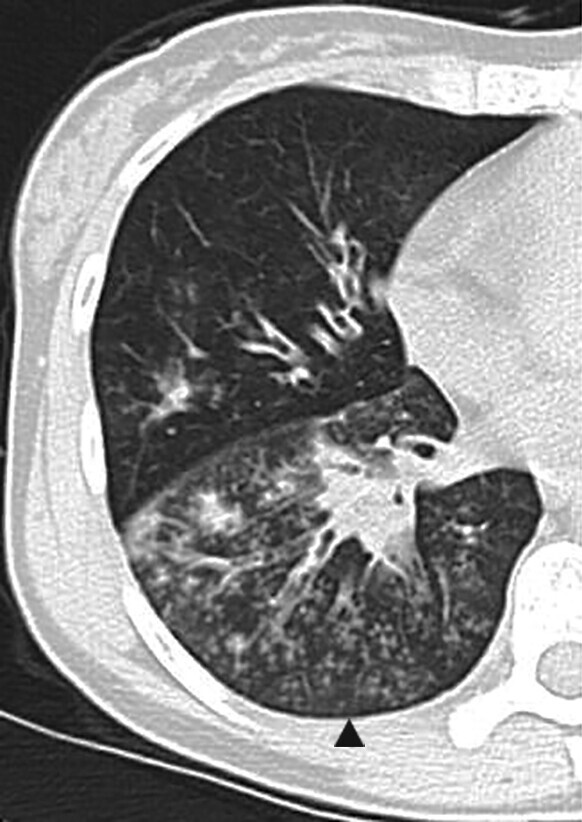
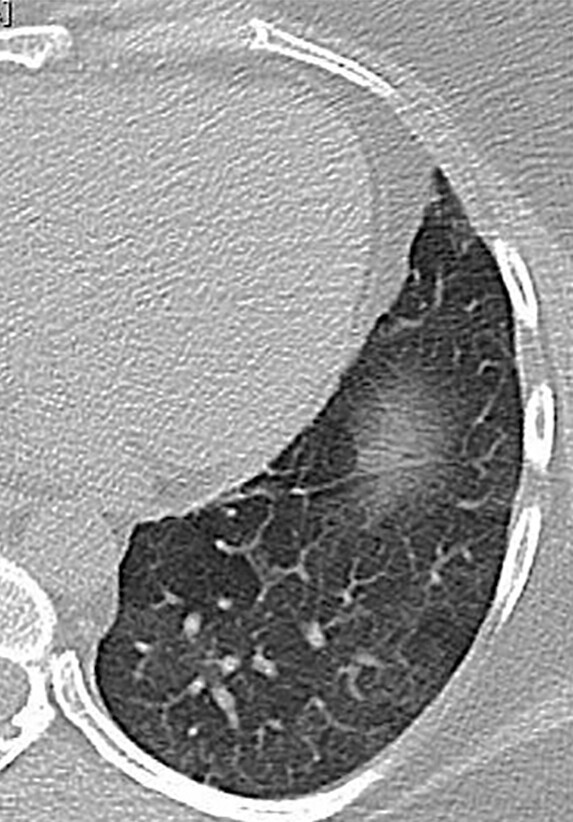
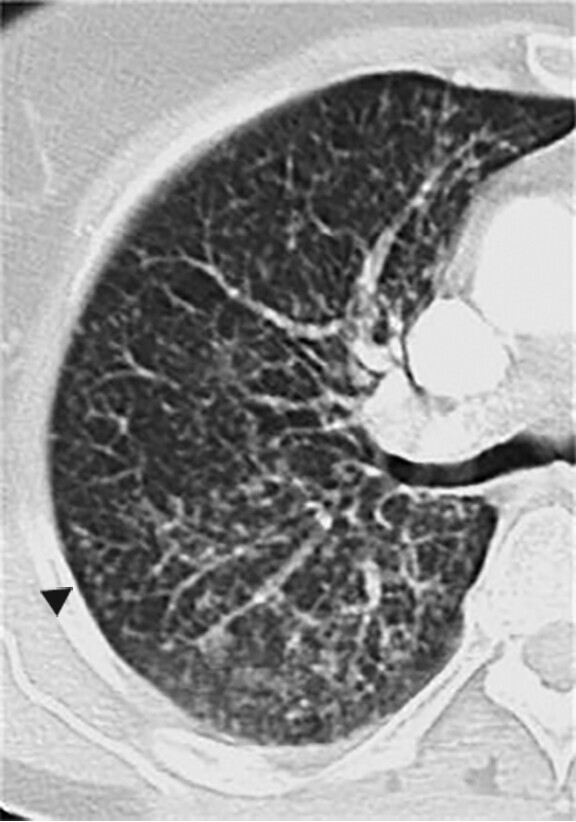
Abb. 72.4 Sekundäre Bronchiolitis.
a 44-jährige Patientin mit zentrilobulären Noduli und Tree-in-Bud-Zeichen (Pfeilspitze) bei pulmonalen Bronchiektasen.
(Quelle: Kroegel C. Bronchiolitis. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. doi: 10.1055/b-002-57146)
b 40-jährige Patientin mit Mosaikmuster als Ausdruck einer Bronchiolitis bei rheumatoider Arthritis.
(Quelle: Kroegel C. Bronchiolitis. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. doi: 10.1055/b-002-57146)
c 81-jährige Patientin mit rheumatoider Arthritis mit zentrilobulären Noduli und Tree-in-Bud-Zeichen (Pfeilspitze).
(Quelle: Kroegel C. Bronchiolitis. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
Histologische Klassifikation
- Auf histopathologischer Ebene lassen sich mehrere Entzündungsmuster differenzieren.
- Die histologischen Befunde korrelieren in gewissem Umfang mit den radiologischen Veränderungen.
- Sie sind jedoch unspezifisch, da eine definierte Bronchiolitis bei sehr unterschiedlichen Ursachen vorkommen kann.
- Umgekehrt verursacht eine definierte Ätiologie unterschiedliche histologische Muster (Abb. 72.1).
Radiologische Klassifikation
- Mit der Thorax-HRCT können direkte und indirekte Zeichen nachgewiesen und unterschieden werden (Abb. 72.7). Sie gehen auf definierte bronchiolitische Prozesse zurück und erlauben gelegentlich Rückschlüsse auf die Ätiologie.
Klassifikation nach dem Krankheitsbeginn und -verlauf
- Auch aus dem Verlauf bronchiolärer Erkrankungen (akut, chronisch) ergeben sich Hinweise auf die zugrunde liegende Ätiologie (Tab. 72.2).
| akut | akut und chronisch | chronisch |
|
|
|
Spezielle Formen der Bronchiolitis
Akute (infektiöse) Bronchiolitis
Definition
- Die akute, meist viral verursachte Bronchiolitis bei Kleinkindern und Kindern (in den ersten 5 Lebensjahren) tritt bevorzugt in den Wintermonaten auf und äußert sich vor allem durch Giemen. Im Erwachsenenalter ist die Erkrankung selten.
Ätiologie
- Der häufigste Auslöser im Kindesalter ist das RS-Virus, seltener Adenoviren, Influenza- und Parainfluenzaviren sowie atypische Bakterien (Mykoplasmen, Chlamydien), bei Erwachsenen auch inhalative Noxen oder Medikamente.
Symptome
- Klinisch imponiert die akute Bronchiolitis durch Tachypnoe, Tachykardie, eine verlängerte Exspiration und (Belastungs-)Dyspnoe.
Körperlicher Untersuchungsbefund
- Oft Giemen und feinblasige Nebengeräusche.
Lungenfunktion
- Lungenfunktionell zeigt sich bevorzugt eine obstruktive Ventilationsstörung.
Bildgebung
- Der radiologische Befund ist variabel: Von der fokalen Lungenüberblähung über fein-noduläre oder lineare Veränderungen bis hin zu fleckigen Milchglastrübungen oder Konsolidierungen und Atelektasen sind viele Befunde möglich.
- In der HRCT finden sich unscharf begrenzte, zentrilobulär gelegene Noduli, fokale Konsolidierungen und ein Mosaikmuster mit fokalen Überblähungen (Air-Trapping).
Therapie
- Die Behandlung der frühkindlichen Bronchiolitis besteht im Wesentlichen aus symptomatischen Maßnahmen.
- Eine antibiotische Behandlung bei Patienten mit akuter Bronchitis ist nicht erforderlich.
- Bei schwereren Formen im Erwachsenenalter mit obstruktiver Ventilationsstörung ist eine antiobstruktive Therapie in Verbindung mit oralen Kortikosteroiden und Makroliden indiziert.
- Lässt sich eine zugrunde liegende virale Infektion nachweisen, sind zusätzlich antivirale Medikamente erforderlich.
Prognose
- Im Allgemeinen gut, die Krankheit heilt in den meisten Fällen aus. Residuen kommen jedoch vor.
Kryptogene Bronchiolitis obliterans (BO)
Definition
- Die kryptogene BO des Erwachsenen ist selten. Die meisten Patienten sind Frauen im mittleren Lebensalter.
Ätiologie
- Kryptogen (idiopathisch), ohne erkennbare Ursache
Symptome
- Meist klagen die Patienten über nicht produktiven Husten, Dyspnoe, Tachypnoe und unspezifische Thoraxbeschwerden (Schmerzen, thorakaler Druck, Ziehen).
- Die Beschwerden bestehen bei Vorstellung meist bereits über einen längeren Zeitraum von 6–24 Monaten.
Körperlicher Untersuchungsbefund
- Bis auf trockene Rasselgeräusche (Giemen, Brummen) unauffällig.
Lungenfunktion
- Die Lungenfunktion (Ganzkörperplethysmografie/Spirometrie) zeigt eine obstruktive Ventilationsstörung mit Überblähung und Atemflusslimitation.
- Bei ausgeprägtem Perfusions-Ventilations-Mismatch ist die Diffusionskapazität reduziert und bei der Blutgasanalyse findet sich eine Hypoxämie in Ruhe, die sich nach Belastung bessert.
Bildgebung
- Der Röntgen-Thorax ist normal oder es findet sich eine bronchitische Zeichnungsvermehrung.
- Gelegentlich ist eine Lungenüberblähung (ohne ausgeprägte Zwerchfellabflachung oder Strukturminderung des Parenchyms) die einzige Veränderung.
- Das Standard-HRCT kann normal sein.
- Im Exspirations-CT sind jedoch Mosaikmuster (Air-Trapping) und Bronchialwandverdickung deutlicher erkennbar.
- Mit Ausnahme des Mosaikmusters ist das Bild der kryptogenen BO nicht von dem bei schwerem Asthma zu unterscheiden.
BAL-Zytologie
- Meist deutliche Neutrophilie (>25% der Granulozyten), die jedoch geringer ausfällt als bei einer bakteriellen Pneumonie.
Histopathologie
- Zelluläre konstriktive Bronchiolitis mit Zeichen der akuten und chronischen Entzündung bevorzugt in den membranösen Bronchioli. Das Interstitium ist meist nicht beteiligt.
Therapie
- Möglichst frühzeitig hochdosiert Kortikosteroide, z.B. Prednison 0,5–1mg/kgKG täglich für 2–3 Monate, dann stufenweise Dosisreduktion, in einigen Fällen niedrig dosierte Fortsetzung über viele Monate bis Jahre.
- Inhalative Kortikosteroide und lang wirksame Bronchodilatatoren.
- ggf. zusätzlich Clarithromycin 2x 250mg/d.
Prognose
- variabel
Hintergrundwissen
Pulmonale Manifestationen bei chronisch-entzündlichen Darmerkrankungen
Neben einer Bronchiolitis können chronisch-entzündliche Darmerkrankungen auch mit anderen pulmonalen Manifestationen einhergehen, wobei die Colitis ulcerosa häufiger als der Morbus Crohn die Ursache ist. Ihr Auftreten ist sehr selten, die Inzidenz ist unbekannt, die Datenlage stützt sich überwiegend auf Fallberichte.
In der Hälfte der Fälle sind die Atemwege betroffen, was sich durch chronischen Husten äußert, teils mit eitrigem Auswurf. Auch das Lungenparenchym kann reagieren (Tab. 72.3). Selten geht die pulmonale Beteiligung der Manifestation im Darm voraus. In Atemwegen und Lungen zeigen sich prominente Bronchialwände und Bronchiektasen, „mucoid impaction“, interstitielle oder bronchiolitische Lungenveränderungen und/oder eine organisierende Pneumonie (OP) sowie granulomatöse Veränderungen (häufiger bei der Colitis ulcerosa). Die lokalisiert auftretenden nekrobiotischen Noduli können einschmelzen und erinnern dann an septische Embolien oder an Noduli bei GPA. Ein Pleuraerguss kann im Rahmen einer Serositis auftreten.
Differenzialdiagnostisch sind 5-Aminosalicylsäure- und Salazosulfapyridin-bedingte pulmonale Nebenwirkungen sowie opportunistische pulmonale Infektionen unter immunsuppressiver Therapie abzugrenzen.
| Atemwege | Parenchym | Pleura |
|
|
Pleuritis |
| NSIP: nicht spezifische interstitielle Pneumonie; OP: organisierenden Pneumonien *sind die häufigsten Befunde |
||
Diffuse Panbronchiolitis
Definition
- Bei der diffusen Panbronchiolitis handelt es sich um eine seltene Erkrankung in Regionen Asiens, die durch eine progressive obstruktive Ventilationsstörung, Bronchiolo- und Bronchiektasien, eine chronische Infektion in Verbindung mit einer chronischen Sinusitis (sinubronchiales Syndrom) und eine Assoziation mit dem HLA-Bw54-Haplotyp gekennzeichnet ist.
Epidemiologie
- Die diffuse Panbronchiolitis ist selten und tritt vor allem im asiatischen Raum auf (China, Korea, Japan), vereinzelt auch in nicht asiatischen Ländern.
- Die Prävalenz liegt bei etwa 11 Fällen auf 100000 Einwohner in Japan.
- Der Erkrankungsgipfel liegt in der 4. und 5. Lebensdekade.
- Männer erkranken etwas häufiger als Frauen (1,4 : 1).
Ätiologie
- Die Ursache der Erkrankung ist unbekannt.
- Es finden sich jedoch familiäre Häufungen und eine Assoziation mit dem HLA-Bw54-Lokus (63% der Erkrankten vs. 11% bei Gesunden).
- HLA-Bw54 oder der zugehörige Haplotyp ist auf einige Mongolenrassen begrenzt, was den ethnischen Hintergrund der Erkrankung erklären könnte.
- ⅔ der Patienten sind Nichtraucher, eine vorausgegangene Exposition gegenüber toxischen Gasen besteht nicht.
Klinik
- Die Erkrankung beginnt subakut mit produktivem Husten (purulentes Sputum), Atemwegsobstruktion und Dyspnoe.
- Zudem besteht bei den meisten Patienten eine chronische Sinusitis, sodass eine Störung der Zilienfunktion als Ursache möglich ist.
- Die Auskultation ergibt ein reduziertes Atemgeräusch und reicht von Giemen (Obstruktion) bis zu mittel- oder grobblasigen feuchten Rasselgeräuschen (Bronchioloektasien).
Merke
Die diffuse Panbronchiolitis zeigt Ähnlichkeiten zur zystischen Fibrose.Laborbefunde
- Eine Leukozytose und eine beschleunigte BSG kommen vor.
- Zusätzlich lassen sich Kälteagglutinine (ohne serologische Hinweise auf Mycoplasma-pneumoniae-Infektion) nachweisen.
- Um die Zugehörigkeit zur Risikogruppe zu prüfen, ist die Bestimmung des HLA-Antigens HLA-Bw54 sinnvoll.
Lungenfunktion
- Die Lungenfunktion zeigt eine obstruktive Ventilationsstörung mit Überblähung .
Bildgebung
- Radiologisch finden sich bis zu 5mm große, unscharf begrenzte zentrilobuläre Noduli, die symmetrisch vor allem im Bereich der Lungenbasis angeordnet sind, auch mit Tree-in-Bud-Muster.
- Zusätzlich zeigt sich eine moderate Überblähung.
- In späteren Stadien können sich zylindrische Bronchi- bzw. Bronchioloektasen ausbilden (Abb. 72.5, Abb. 72.6).
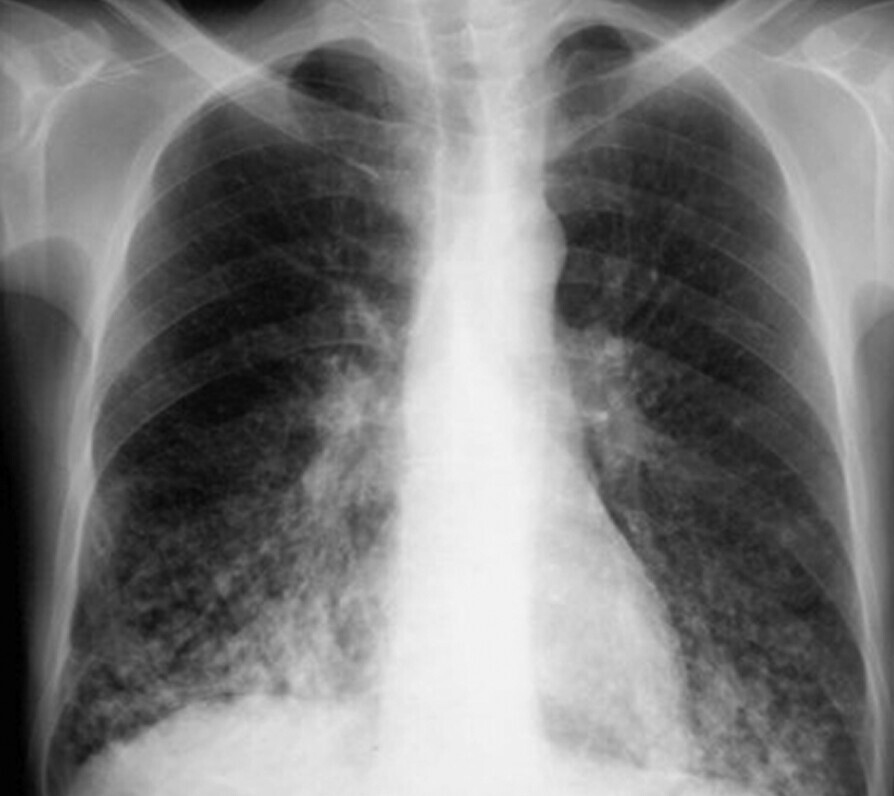
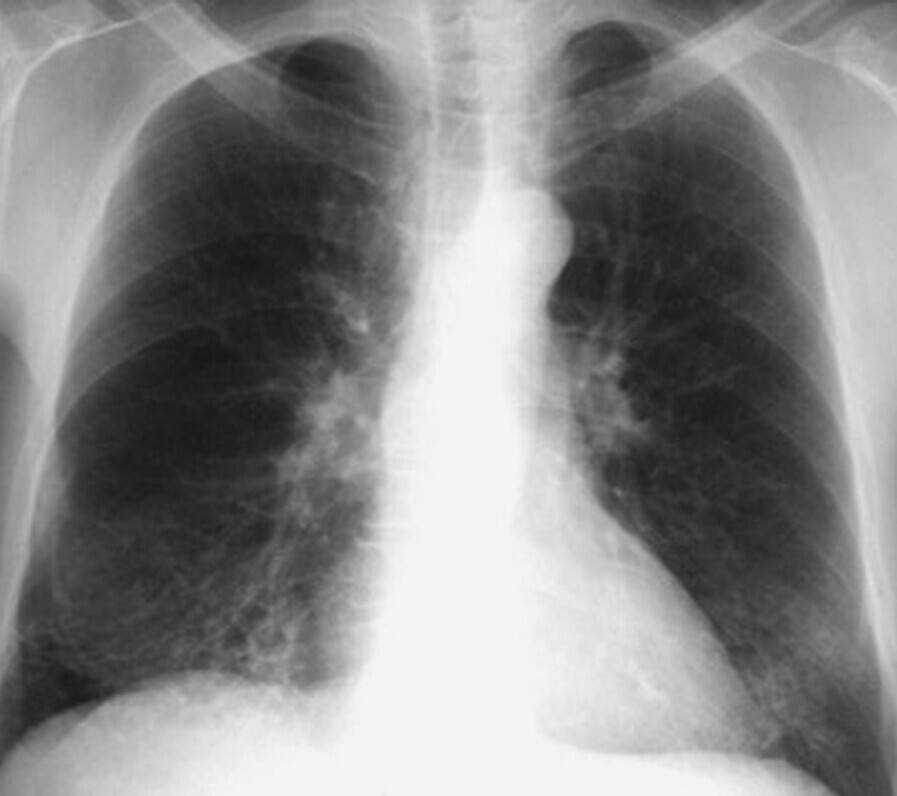
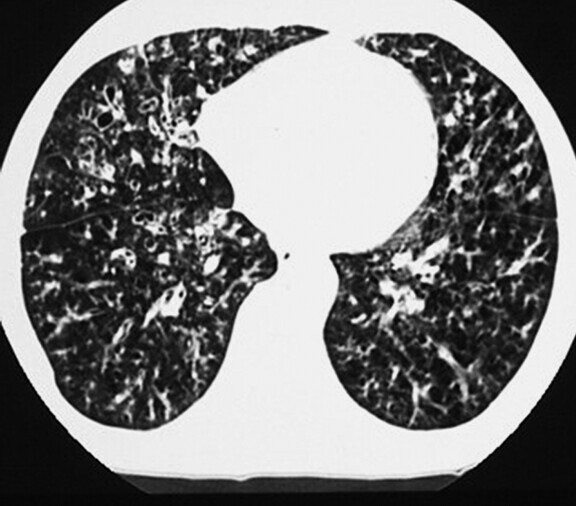
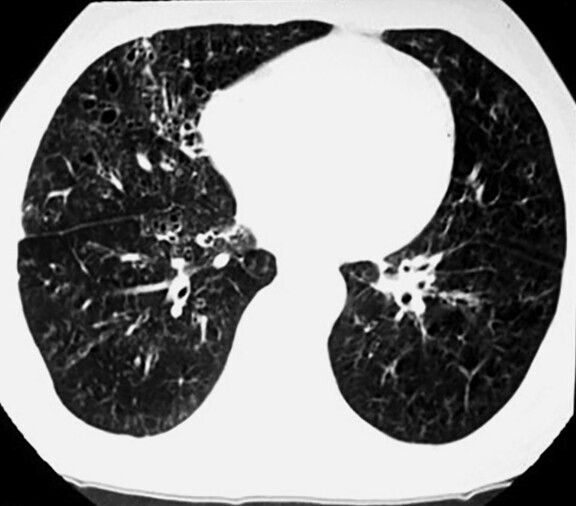
Abb. 72.6 HRCT bei diffuser Panbronchiolitis (DPB).
a Zentrilobuläre Noduli mit Tree-in-Bud-Zeichen sowie Bronchi- und Bronchioloektasie
b Gute Rückbildung nach einem Jahr Erythromycin-Therapie.
Histologie
- Histologisch findet sich eine bronchiolozentrische Infiltration von Lymphozyten, Plasmazellen und schaumigen Histiozyten im Bereich der respiratorischen Bronchioli und den angrenzenden Alveolargängen und Alveolen.
Diagnostik
- Die Diagnose kann auf dem Boden diagnostischer Kriterien (Tab. 72.4) in Verbindung mit dem ethnischen Hintergrund (asiatisch) und dem Nachweis von HLA-Bw54 gestellt werden.
- Nur selten ist eine histologische Abklärung erforderlich.
| Hauptkriterien | Nebenkriterien | |
|
|
|
- Eine niedrig dosierte Makrolidtherapie ist die Therapie der Wahl, wobei sich die Dauer der Behandlung am Eintreten einer (vollständigen) Besserung orientiert und mehrere Jahre betragen kann.
- Da ein therapeutischer Effekt erst nach 2–3 Monaten zu erkennen ist, sollte die Behandlung mind. 6 Monate durchgeführt werden:
- Wahl: Erythromycin (2 oder 3x 200mg/d) oral
- Wahl (bei nachlassender Wirkung oder Nebenwirkungen des Erythromycins): Clarithromycin (2x 500mg/Tag oral) oder Roxithromycin (1 oder 2x 150mg/Tag oral)
- bei vollständigem therapeutischem Effekt: Beendigung der Behandlung nach 2 Jahren
- bei unzureichendem (partiellem) Effekt bzw. bei schweren Fällen (Bronchioloektasen und/oder respiratorische Insuffizienz):
- trotz Besserung Fortführung der Therapie über 2 Jahre hinaus
- Der Verlauf ist durch eine progrediente Lungenfunktionsstörung mit episodischen bakteriellen Superinfektionen (häufig durch P. aeruginosa) charakterisiert.
- Ursprünglich verstarben 50% der Patienten innerhalb von 5 und 75% innerhalb von 10 Jahren nach Diagnosestellung.
- Seit der Makrolidtherapie deutlich bessere Prognose mit einer 5-Jahresüberlebensrate von 90%.
Symptomatik
- Die Beschwerden von Patienten mit bronchiolären Erkrankungen sind unspezifisch.
- Im Vordergrund stehen ein (meist unproduktiver) Husten und eine zunehmende Dyspnoe, die sich entweder akut oder allmählich manifestieren.
- Husten mit voluminösem Auswurf wird vor allem bei infektiöser Bronchiolitis und diffuser Panbronchiolitis beobachtet.
Diagnostik
Diagnostisches Vorgehen- Der diagnostische Zugang (Tab. 72.5) gliedert sich in 4 Stufen (Abb. 72.7):
- Schritt – Anamnese und körperliche Untersuchung
- Schritt – Röntgen-Thorax und Lungenfunktion
- Schritt – HRCT (mit Exspirationsaufnahmen)
- Schritt – invasivere Diagnostik (BAL, Biopsie)
Merke
In den histologisch nicht zu sichernden Fällen mit Bronchiolitis sollten die anamnestischen, klinischen und radiologischen Befunde in einem Konsil interdisziplinär besprochen werden.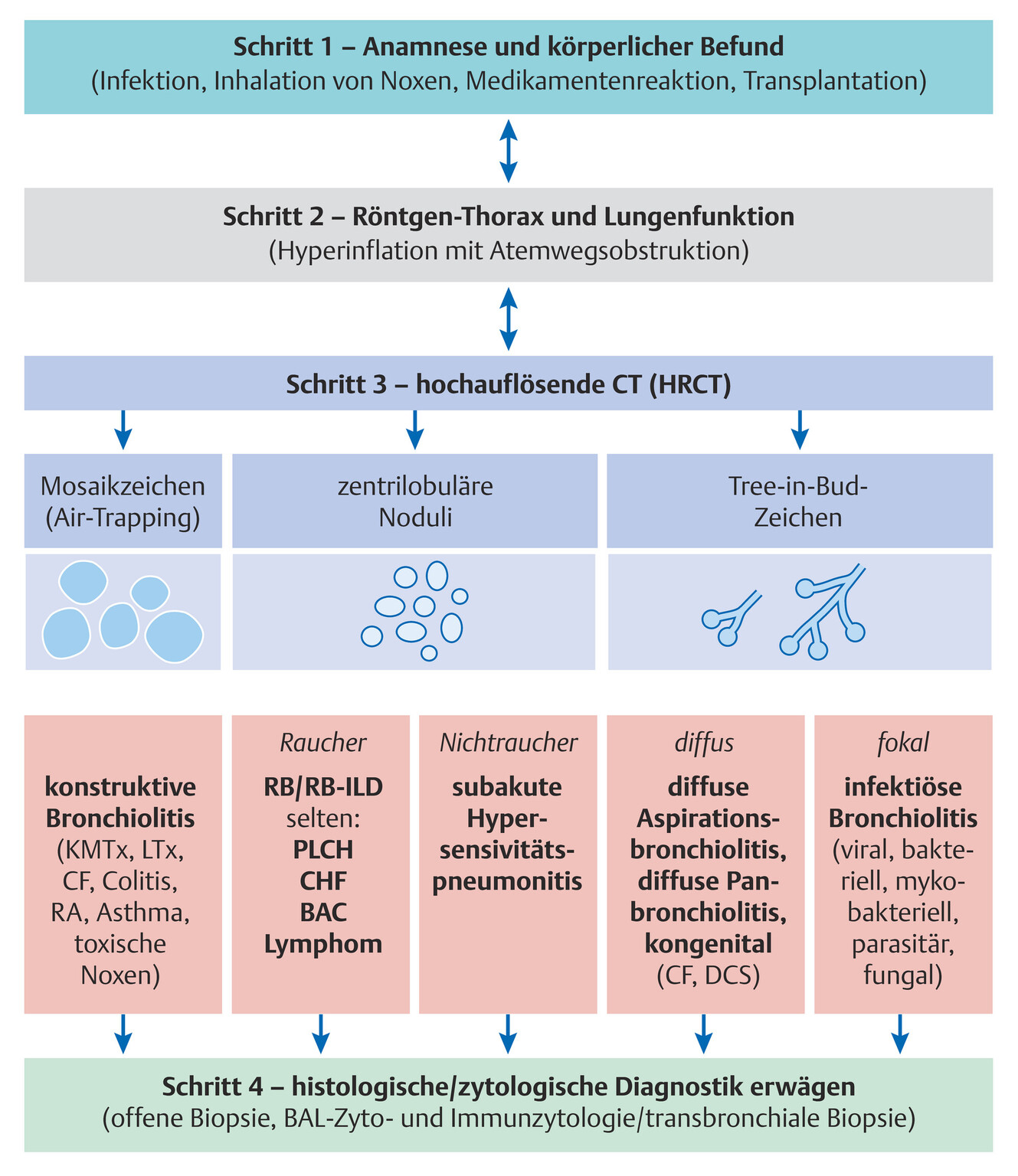
Abb. 72.7 Diagnostischer Algorithmus bei Verdacht auf Bronchiolitis.
Direkte und indirekte Zeichen der Bronchiolitis in der CT/HRCT. BAC: bronchoalveoläres Karzinom; CF: zystische Fibrose; CHF: Herzinsuffizienz; DCS: dyskinetisches Ziliensyndrom; KMTx: Knochenmarktransplantation; LTx: Lungentransplantation; PLCH: pulmonale Langerhans-Zell-Histiozytose; RA: rheumatoide Arthritis; RB-ILD: respiratorische Bronchiolitis mit interstitieller Lungenerkrankung.
(Quelle: nach Daten aus Kroegel C, Haidl P, Kohlhäufl M, Voshaar T. Bronchiolitis. Teil 1 – Anatomische Grundlagen, Klassifikation, klinische Präsentation und Bildgebung. Pneumologie. 2012; 66:28–38)
| Bronchiolitis-Typ | Ursache oder assoziierte Erkrankung | HRCT-Befund | Histologie | Differenzialdiagnosen |
| infektiös | akute oder chronische Infektion (Viren, Mykoplasmen, Mykobakterien) |
|
transmurale, entzündliche Infiltration der Bronchioli | exogen allergische Alveolitis (EAA) |
| exogen allergische Alveolitis | inhalierte organische oder anorganische Substanzen |
|
bronchioläre und peribronchioläre lymphoplasmozytische Infiltration (± Granulozyten) | respiratorische Bronchiolitis |
| Respiratorische Bronchiolitis (RB/RB-ILD) | Nikotinabusus (Rauchen) |
|
intra- und peribronchioläre Akkumulation von pigmentierten Raucher-Makrophagen |
|
| folikuläre und lymphozytische Bronchiolitis |
|
|
Intra- und peribronchioläre Lymphozytenakkumulation Lymphfollikelhyperplasie |
|
| diffuse Panbronchiolitis | idiopathisch |
|
transmurale, entzündliche Infiltration der Bronchioli Akkumulation von schaumigen Histiozyten |
|
| Bronchiektasen |
|
|
entzündliche und/oder fibrotische Bronchiolitis |
|
| konstriktive (obliterative) Bronchiolitis |
|
|
Verengung oder Obliteration des bronchiolären Lumens durch progressive Entzündung und Fibrose |
|
Anamnese
Eine für die Bronchiolitis relevante Anamnese berücksichtigt:
- Beginn und Dauer der Symptome
- eine möglicherweise bestehende Grunderkrankung (immunologische Erkrankungen, Kollagenosen)
- eine mögliche Exposition gegenüber inhalativen Noxen (toxische Gase, Mineralstäube, organische Stäube, Rauchen)
- Infektionen des Respirationstrakts
- Medikamente (D-Penicillamin, Gold, Mesalazin, Sirolimus, Rituximab), die eine Bronchiolitis obliterans verursachen können
- Status nach Transplantation
- den ethnischen Hintergrund (in Japan, China, Korea: diffuse Panbronchiolitis)
- hereditäre Erkrankungen (zystische Fibrose, primäre Ziliendyskinesie), die ein Hinweis auf eine bronchioläre Erkrankung sein können
- bei älteren, bettlägerigen Patienten oder bei oropharyngealer Dysphagie ist an eine chronische Aspirationsbronchiolitis zu denken
- eine akute diffuse (Pan-)Bronchiolitis kann auch bei nicht asiatischen Personen z.B. im Rahmen eines Infekts auftreten (Abb. 72.8)
- bei Immunsuppression sollte an die Möglichkeit einer Virus- oder Pneumocystis-jirovecii-assoziierten Bronchiolitis gedacht werden
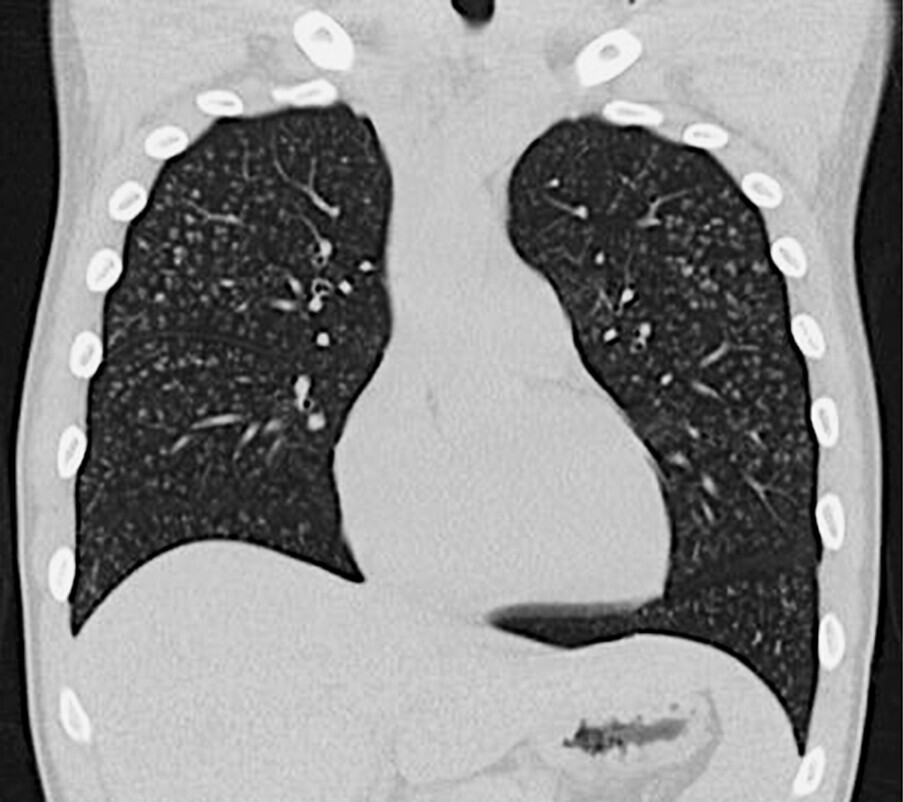
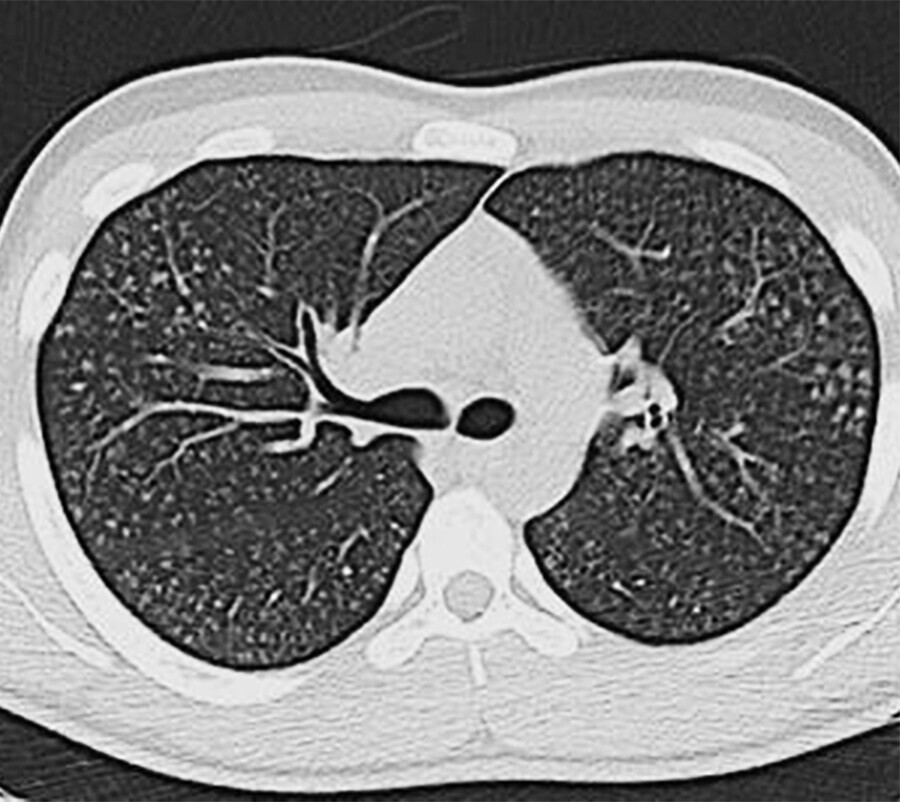
Abb. 72.8 Diffuse Panbronchiolitis.
Bei einem 17-jährigen Patienten mit diffus verteilten, zentrilobulären Noduli in allen Lungenabschnitten. Klinisch bestand ein trockener Husten seit 14 Tagen und bei Aufnahme eine Ruhedyspnoe mit schwerer hypoxämischer Insuffizienz. Die CT-Aufnahmen erinnern an eine Mykoplasmen-Pneumonie. Ein Erreger konnte allerdings nicht nachgewiesen werden. Unter einer breiten antibiotischen Therapie und systemischen Kortisontherapie bildeten sich die Dyspnoe und die radiologischen Veränderungen zurück.
a CT-Frontalschnitt.
(Quelle: Kroegel C. Bronchiolitis. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
b CT-Transversalschnitt in Höhe der Hauptcarina.
(Quelle: Kroegel C. Bronchiolitis. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
Körperliche Untersuchung
Der klinische Untersuchungsbefund ist meist unauffällig. Gelegentlich finden sich:- ein vergrößerter anterior-posteriorer Thoraxdurchmesser (Fassthorax)
- ein hypersonorer Klopfschall (Lungenüberblähung bei Air-Trapping)
- eine verlängerte Exspiration
- ein exspiratorisches Giemen (bei Obstruktion)
- mittel- bis grobblasige feuchte Nebengeräusche (bei Bronchiolo- bzw. Bronchiektasen)
- sog. inspiratorisches Juchzen (inspiratory squeaks) bevorzugt bei der exogen-allergischen Alveolitis (20–30 % der Patienten)
Merke
Klinische Zeichen der Obstruktion sprechen eher für eine konstriktive Bronchiolitis und gegen eine exogen allergische Alveolitis oder kryptogene organisierende Pneumonie.Labor
- Spezifische Laborparameter für die Bronchiolitis sind nicht verfügbar.
- Blutbild und Entzündungsparameter sind in der Regel wenig nützlich und können allenfalls auf eine bestehende Infektion hindeuten.
- Bei Verdacht auf eine diffuse Panbronchiolitis lässt sich das Erkrankungsrisiko mittels des HLA-Antigens (HLABw54) bestimmen.
- Beim Bronchiolitis-obliterans-Syndrom kann die entzündliche Aktivität anhand des exspiratorischen Stickstoffmonoxids (eNO) ermittelt werden.
- Die Analyse der Immunglobuline oder der Immunzellen erlaubt Hinweise auf einen Immundefekt.
Bildgebende Diagnostik
Röntgen
Die Röntgen-Thorax-Übersicht ist meist unauffällig. Gelegentlich zeigen sich uncharakterische Veränderungen:
- pulmonale Überblähung bei konstriktiver Bronchiolitis
- noduläres bzw. retikonoduläres Zeichnungsmuster bei ILD-assoziierter Bronchiolitis
- verbreiterte Atemwegswände
CT
- Normale Bronchioli lassen sich in der HRCT aufgrund der geringen Wanddicke (ca. 0,1mm) nicht darstellen. Erst die bronchiolitische Reaktion macht die Bronchioli in den peripheren Lungenabschnitten sichtbar.
- Der HRCT-Befund zeigt bestimmte Muster, die für eine diagnostische Eingrenzung der Erkrankungen von Bedeutung sind (Abb. 72.7 Abb. 72.9). Die mit bronchiolärer Erkrankung assoziierten Veränderungen lassen sich in direkte und indirekte Zeichen unterscheiden (Abb. 72.7).
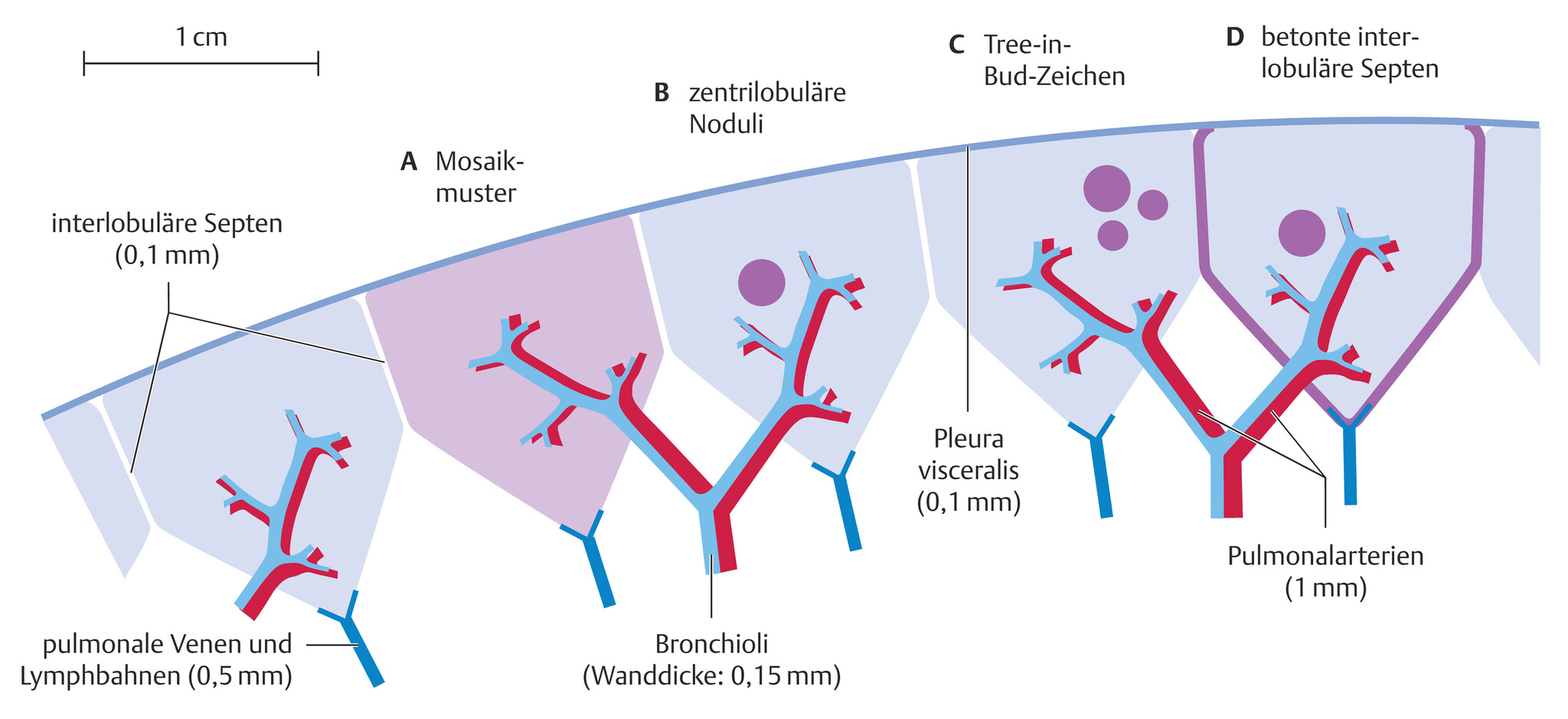
Abb. 72.9 Anatomische Verhältnisse des sekundären Lobulus (Schema) mit Mosaikmuster.
(A), zentrilobulären Noduli (B), dem Tree-in-Bud-Zeichen (C) und verbreiterten interlobulären Septen (D).
(Quelle: nach Daten aus Kroegel C, Haidl P, Kohlhäufl M, Voshaar T. Bronchiolitis. Teil 1 – Anatomische Grundlagen, Klassifikation, klinische Präsentation und Bildgebung. Pneumologie. 2012; 66:28–38)
Direkte Zeichen
- Zu den direkten Zeichen gehören das sog. Tree-in-Bud-Muster und zentrilobuläre Noduli (Abb. 72.9).
- Das Tree-in-Bud-Muster (Tree-in-Bud-Zeichen, Baumknospen- oder Blütenzweig-Zeichen) beruht auf einer Verdickung der bronchiolären Wand, Füllung des bronchiolären Lumens und anliegender Alveolen durch visköses Exsudat (z.B. bei infektiöser bzw. exsudativer Bronchiolitis).
- In der HRCT imponiert es entweder als pleuranahe „V“- oder „Y“-förmige Aufzweigung in Verbindung mit einer Ansammlung scharf abgegrenzter zentrilobulärer Verdichtungen, die an einen Blütenzweig erinnern (Abb. 72.4, Abb. 72.7).
- Unscharf begrenzte zentrilobulären Noduli sind Ausdruck entzündlicher Veränderungen im bronchiolären und peribronchiolären Raum ohne Mukusimpaktion und in der HRCT als unscharf definierte, wenige Millimeter große, flaue Noduli sichtbar (Abb. 72.7, Abb. 72.8, Abb. 72.9).
- Unabhängig von Typ und Ätiologie sind diese Noduli ebenso wie die Tree-in-Bud-Veränderungen etwa 5–10mm von der pleuralen bzw. septalen Oberfläche entfernt und von anderen nodulären Mustern zu unterscheiden (Abb. 72.10). Je nach Ätiologie kommen beide Formen entweder fokal oder diffus vor.
- Unscharf begrenzte zentrilobuläre Noduli (fokal oder diffus) finden sich v.a. bei infektiöser Bronchiolitis (Viren oder Mykoplasmen), follikulärer Bronchiolitis (z.B. bei HIV-Infektion), Mineralstaub-Bronchiolitis oder RB-ILD (oft diffus) sowie bei Bronchiektasen oder Tuberkulose (fokal), aber auch beim multifokal oder lobulär auftretenden bronchoalveolären Karzinom.
- Ein diffus verteiltes Tree-in-Bud-Muster in Verbindung mit zentralen Bronchiektasen spricht für ABPA.
- Fehlen zentrale Bronchiektasen, kommt eher eine diffuse Panbronchiolitis in Betracht.
- Ein lokalisiertes Tree-in-Bud-Muster findet sich bevorzugt bei Mycobacterium-tuberculosis-Infektionen (meist im Oberlappen) und nicht tuberkulösen Mykobakteriosen (meist Mittellappen und Lingula).
- Schließlich tritt das Tree-in-Bud-Muster oft gemeinsam mit zentrilobulären Noduli bei Bronchiektasen fokal auf.
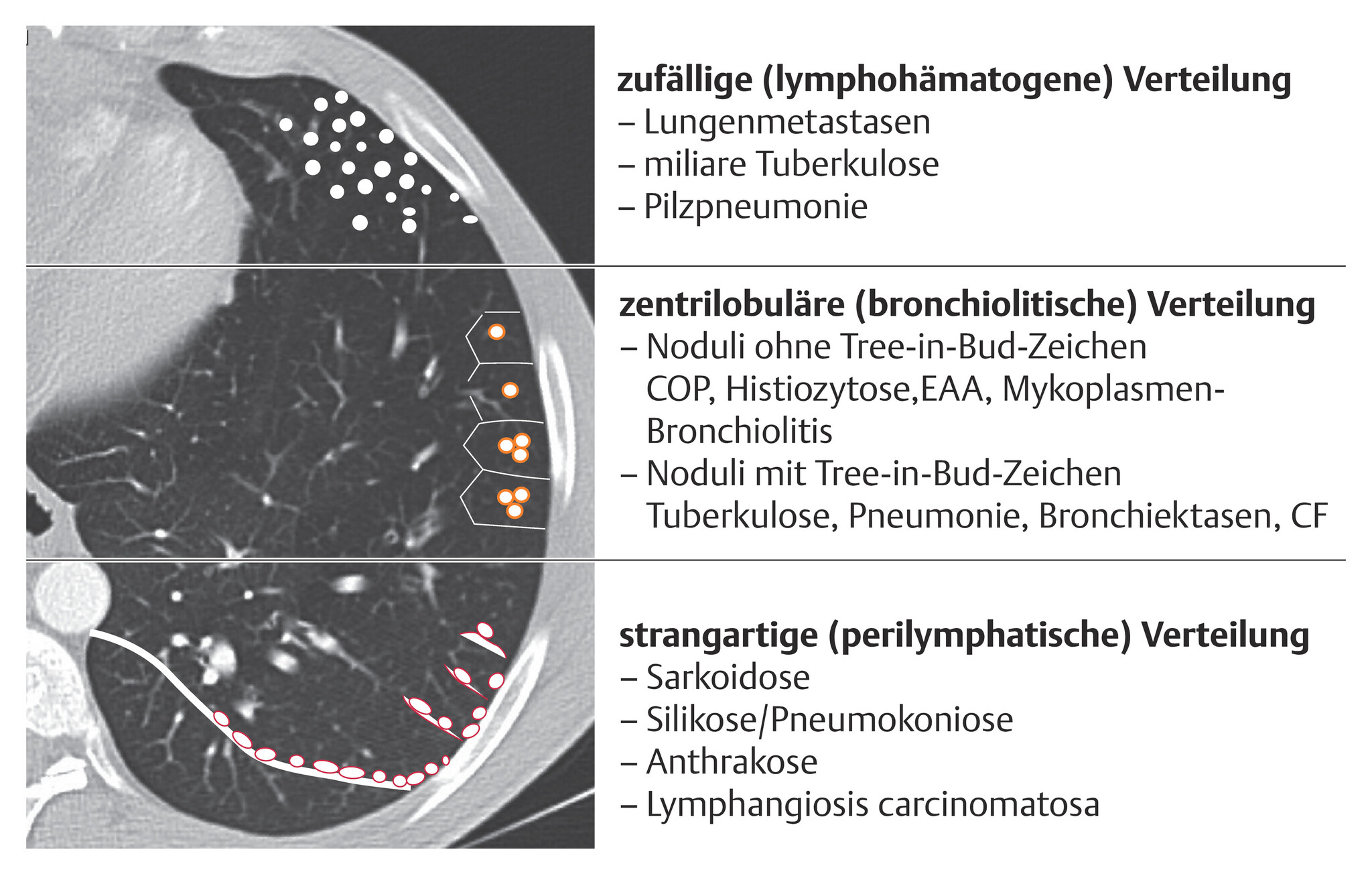
Abb. 72.10 Differenzialdiagnostik des nodulären Musters in der CT.
COP: kryptogene organisierende Pneumonie; EAA: exogen allergische Alveolitis; CF: zystische Fibrose.
(Quelle: Kroegel C. Bronchiolitis. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
Indirekte Zeichen
- Diese resultieren aus einer obstruktiven Erkrankung der kleinen Atemwege (konstriktive bzw. obliterative Bronchiolitis). Sie können entweder allein oder in Verbindung mit den direkten Zeichen bronchiolärer Erkrankungen auftreten.
- Das Mosaikmuster ist durch multiple lokale überblähte Lungenabschnitte (lokales Air-Trapping) neben normalen ventilierten Bereichen charakterisiert.
- Dies lässt sich vor allem in Exspiration darstellen („Exspirations-HRCT“).
- Es handelt sich dabei um eine flächenhafte oder umschriebene subsegmentale Parenchymüberblähung einzelner oder mehrerer sekundärer Lobuli.
- Ursache hierfür ist eine ungleichmäßige Ventilation der Lungenperipherie.
- Die inhalierte Luft gelangt zwar während der Inspiration in die Alveolarräume, können diese infolge der bronchiolären Obstruktion jedoch während der Exspiration nicht verlassen (Air-Trapping).
- Die nebeneinander vorkommenden Bereiche unterschiedlicher Lungendichte gehen auf Perfusionsunterschiede zurück, die ihrerseits auf einer hypoxischen Vasokonstriktion beruhen.
- Eine mosaikartige Perfusion ist allerdings unspezifisch und kann auch bei Herzinsuffizienz beobachtet werden.
- Der Prototyp des Mosaikmusters ist die konstriktive oder obliterative Bronchiolitis (BO) (Abb. 72.11) bei Lungen- und allogener Stammzelltransplantation.
- Darüber hinaus kann es aber auch bei anderen Bronchiolitiden nachzuweisen sein.
- Das Drei-Dichten-Muster (three-density pattern) entsteht, wenn 3 unterschiedliche Lungendichten nebeneinander existieren: normale Parenchymdichte, erhöhte Dichte bzw. Milchglastrübung und geringere Dichte bzw. Mosaikperfusion, man spricht auch vom „Headcheese-Zeichen (Abb. 72.12).
- Dieses Bild spricht für eine Bronchiolitis bei infiltrativer/interstitieller Erkrankung und legt v.a. eine exogen-allergische Alveolitis (EAA) nahe.
- Nur selten tritt das „Headcheese-Zeichen“ auch bei RB-ILD, follikulärer Bronchiolitis, Sarkoidose und atypischer Pneumonie auf.
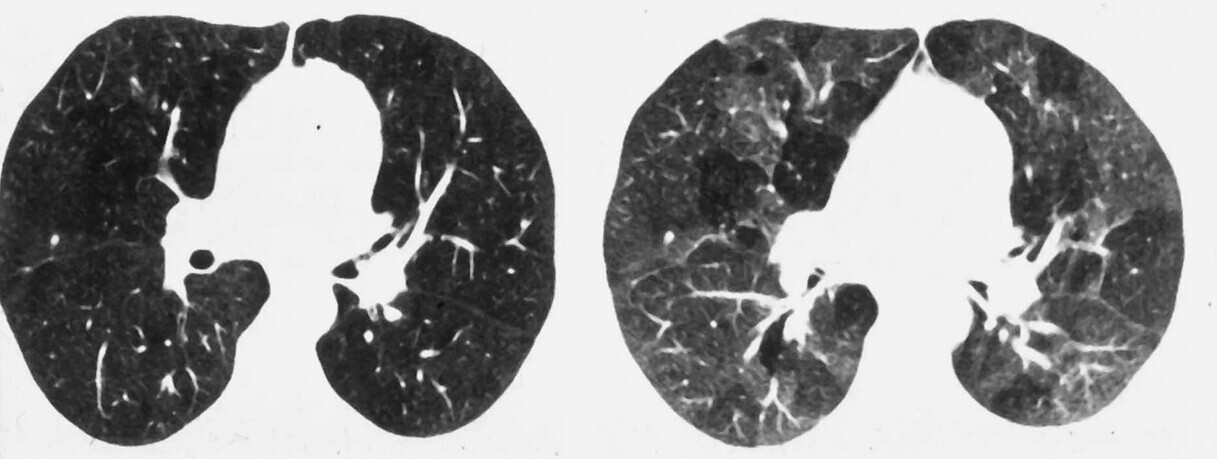
Abb. 72.11 HRCT bei Bronchiolitis obliterans (BO).
Mosaikmuster (Air-Trapping), welches in Inspiration nur angedeutet, in Exspiration ausgeprägt zur Darstellung kommt.
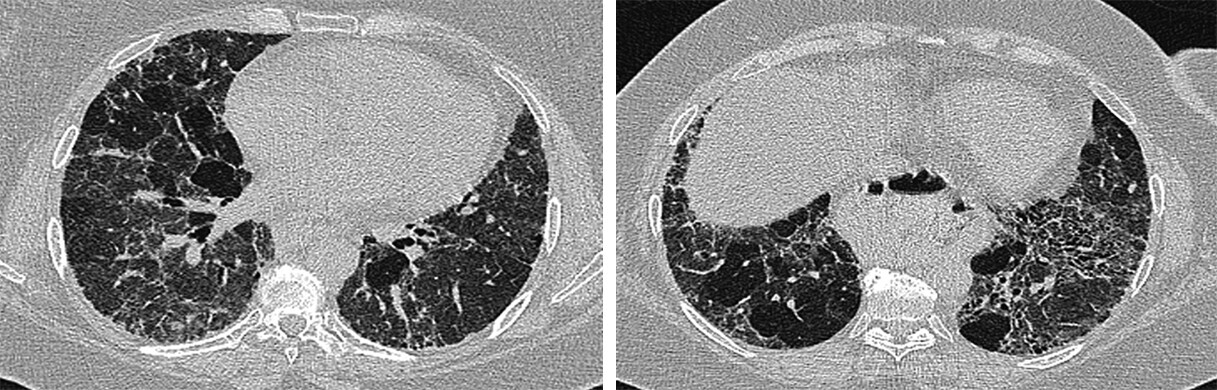
Abb. 72.12 HRCT bei chronischer exogen allergischer Alveolitis.
Typisches Drei-Dichten-Muster (Headcheese-Zeichen) mit 3 nebeneinander existierenden unterschiedlichen Lungendichten: normale Parenchymdichte, erhöhte Dichte (Milchglastrübung) und verminderte Dichte (Air-Trapping).
Instrumentelle Diagnostik
Lungenfunktion
Ein unauffälliger Befund kann vorkommen (BOS). Folgende Muster sind möglich:
- Obstruktive Ventilationsstörung bei primären Bronchiolitiden (z.B. konstriktive Bronchiolitis, diffuse Panbronchiolitis) sowie sekundären Bronchiolitiden in Verbindung mit Erkrankungen der großen Atemwege.
- Restriktive oder kombinierte obstruktiv/restriktive Ventilationsstörung bei den sich im distalen Azinus manifestierenden interstitiellen Erkrankungen (EAA, RB-ILD, OP).
- Hypoxämische respiratorische Insuffizienz und reduzierte Diffusionskapazität je nach Schweregrad und zugrundeliegender Ursache.
BAL
Zur Differenzial- und Immunzytologie der BAL bei Bronchiolitiden liegen nur wenige Untersuchungen vor:
- EAA: hohe Gesamtzahl, starke Lymphozytose (>40%), leichte Eosinophilie (1–6%) und Neutrophilie (3–9%), vereinzelt Plasmazellen, Schaummakrophagen, variabler CD4/CD8-Quotient
- Pulmonale Langerhans-Zell-Histiozytose: Vermehrung (>3%) CD1a- und Langerin exprimierender BAL-Zellen (Langerhans-Zellen)
- Respiratorische Bronchiolitis-ILD (RB-ILD): makroskopisch gelb-bräunliche („schmutzige“) Farbe der Lavageflüssigkeit (Raucherpigmentbeladene Makrophagen), neben Vermehrung von Rauchermakrophagen diskrete Neutrophilie/Eosinophilie möglich
- Kryptogene obliterative Bronchiolitis: Neutrophilie (>25%) mit leichter Eosinophilie (1–6%) und relativer Vermehrung der CD8+-T-Lymphozyten
Bronchoskopie
- Eine Bronchoskopie mit mikrobieller Analyse kann zum Nachweis einer Infektion nützlich sein. Ebenso wichtig ist eine BAL mit Differenzial- und Immunzytologie.
Histologie, Zytologie und klinische Pathologie
Histologische Lungendiagnostik- In vielen Fällen reicht die integrierte Interpretation von HRCT-Befund und Anamnese, körperlichem Befund und Lungenfunktion für die Diagnose aus, sodass eine bioptische Sicherung nur in Einzelfällen erforderlich ist.
- Alle übrigen Fälle bedürfen zur Diagnose einer Bronchoskopie einschließlich BAL und transbronchialer Biopsie. Allerdings sind die mittels transbronchialer Biopsie gewonnenen Gewebeproben wie bei interstitiellen Erkrankungen zur histologischen Diagnose meist unzureichend, sodass eine Kryobiopsie oder offene Lungenbiopsie anzustreben ist.
- Bei einer Bronchiolitis obliterans nach Herz-/Lungentransplantation wird eine transbronchiale Biopsie an mind. 5 verschiedenen Stellen empfohlen.
Differenzialdiagnosen
- bei normalem Röntgenbild:
- beginnendes Lungenemphysem
- beginnende Linksherzinsuffizienz
- rezidivierende Lungenembolie
- bei interstitiellen Lungenveränderungen:
- das gesamte ILD-Spektrum (insbesondere exogen-allergische Alveolitis
- Langerhanszell-Histiozytose, Sarkoidose, Pneumokoniosen)
- Miliartuberkulose
- atypische Pneumonie
- bei fleckigen Infiltraten:
- atypische Pneumonie
- Mykobakteriosen
- organisierende Pneumonie
- zystische Fibrose
- allergische bronchopulmonale Aspergillose
- Infiltrate bei CVID und anderen Immundefekten
- rezidivierende Lungenembolie
Therapie
Therapeutisches Vorgehen
- Abgesehen vom Bronchiolitis-obliterans-Syndrom nach Lungentransplantation und in gewissem Umfang auch der BOOP/COP gibt es nur wenige Studien, die das günstigste therapeutische Vorgehen bei Bronchiolitis belegen. Daher sind die Empfehlungen empirisch, beruhen auf Einzelfällen und variieren z.T. erheblich von Zentrum zu Zentrum. Grundsätzlich besteht die Behandlung aus einer antientzündlichen, antiobstruktiven und ggf. antibiotischen Therapie.
Antientzündliche Therapie
- Die Therapie mit oralen Kortikosteroiden wird bei BOOP/COP zunächst über 1 Jahr durchgeführt.
- Bei den nicht seltenen Rezidiven (bis zu 50%) muss die Behandlung wieder aufgenommen werden.
- Bei Manifestation eines BOS ist initial eine hochdosierte Kortisontherapie sinnvoll (Tab. 72.6).
- Die Bedeutung inhalativer Kortikosteroide für die Behandlung von BOOP/COP, ebenso wie der BOS und anderer Formen der Bronchiolitis, ist nicht bekannt.
- Bis zum Beweis ihrer fehlenden Wirksamkeit sollte jedoch eine inhalative Behandlung bevorzugt mit bronchioligängigen Medikamenten (kleinpartikuläre Darreichungsformen) durchgeführt werden.
Antibiotika (Makrolide)
- Ein Teil der Bronchiolitiden (DPB, COP) spricht auf eine immunmodulatorische Langzeittherapie mit niedrig dosierten Makroliden (Erythromycin, Azithromycin, Clarithromycin) an (Tab. 72.6).
Antiobstruktive Therapie
- Während eine antientzündliche Therapie bei nahezu allen Bronchiolitis-Formen durchgeführt wird, besteht darüber hinaus eine Indikation zur antiobstruktive Behandlung nur bei Nachweis einer Atemwegsobstruktion.
| Medikamente | Indikation | Dosierung | |
| systemische Kortikosteroide | BOS | z.B. 250mg Methylprednisolon über 7 Tage, dann langsame Reduktion auf eine Erhaltung sdosis über 3–6 Monate, bei Rezidiv Dosiserhöhung |
|
| BOOP, idiopathische therapierefraktäre Formen* | z.B. 40mg Prednison über 4 Wochen, dann langsame Reduktion auf eine Erhaltungsdosis, ab Monat 7 über weitere 6 Monate, ab Monat 13 ausschleichen; bei Rezidiv erneute orale Kortisontherapie | ||
| inhalative Kortikosteroide** | idiopathische therapierefraktäre Formen | kleinpartikuläre Darreichungsformen über mind. 3 Monate (auch parallel mit oralen Kortikosteroiden) | |
| Makrolide | BOS, RSV-Bronchiolitis, Mykoplasmen-Bronchiolitis, BOOP/COP, DPB |
|
|
| Virostatika | virusinduzierte Bronchiolitis |
CMV:
HSV:
|
|
| β2-Mimetika | obstruktive Ventilationsstörung | je nach Medikament 2x tgl. 1–2 Hübe | |
| * abgesehen von der BOOP/COP und dem BOS liegen wenige bzw. keine Erfahrungen für die orale Kortisontherapie vor ** die Bedeutung der inhalativen Kortikosteroide für die Therapie einzelner Bronchiolitiden ist noch nicht hinreichend belegt BOOP: Bronchiolitis obliterans mit organisierender Pneumonie; BOS: Bronchiolitis obliterans Syndrom; DPB: Diffuse Panbronchiolitis; CMV: Zytomegalievirus; HSV: Herpes Simplex Virus |
|||
Verlauf und Prognose
- Wechselnde Prognose in Abhängigkeit von der Genese und vom Zeitpunkt des Therapiebeginns.
- Kryptogene Bronchiolitis obliterans und BOS: Bei fehlendem Ansprechen auf Steroide häufig Progredienz mit letalem Ausgang.
- BOOP/COP: in der Regel gutes Ansprechen auf Therapie und günstige Prognose.
Synonyme
- Keine
Keywords
- Atemwegserkrankung
- Bronchiolitiden
- Inflammation
- Erkrankungen der kleinen Atemwege
Literatur zur weiteren Vertiefung
- [1] Abbott GF, Rosado-de-Christenson ML, Rossi SE et al. Imaging of small airways disease. J Thorac Imaging 2009; 24: 285–298
Suche in: PubMed Google Scholar - [2] Kroegel C, Haidl P, Kohlhäufl M et al. Bronchiolitis. Teil 1 – Anatomische Grundlagen, Klassifikation, klinische Präsentation und Bildgebung. Pneumologie 2012; 66: 28–38
Suche in: PubMed Google Scholar - [3] Kroegel C, Haidl P, Kohlhäufl M et al. Bronchiolitis. Teil 2 – Diagnostischer Zugang und Therapie. Pneumologie 2012; 66: 78–88
Suche in: PubMed Google Scholar - [4] Kudoh S, Keicho N. Diffuse panbronchiolitis. Clin Chest Med 2012; 33: 297–305
Suche in: PubMed Google Scholar - [5] Lynch JP, Weigt SS, DerHovanessian A et al. Obliterative (constrictive) bronchiolitis. Semin Respir Crit Care Med 2012; 33: 509–532
Suche in: PubMed Google Scholar
Herausgeber*innen, Autor*innen
Herausgeber*innen: Claus Kroegel, Ulrich Costabel, Robert Bals, Christian Taube
Autor*innen: Ulrich Costabel, Claus Kroegel
Letzte Änderung: 20.03.2024
